TONOPS®は、柔軟なカスタマイズができる「セミパッケージ方式」の特性を活かし、医薬品のCSV(コンピュータ化システムバリデーション)のガイドラインに準拠した生産プロセスと、情報管理を支える生産管理システムを構築できます。当社では独自のCSV管理規定を定めており、CSV対応に関する文書作成を幅広く支援する体制を整えています。
CSV(コンピュータ化システムバリデーション)とは
医薬品製造におけるCSV(Computerized System Validation)は、医薬品、医薬部外品、化粧品および医療機器の開発・製造に使用されるコンピュータ化システムについて、開発プロセスの最適性と妥当性を検証し文書化することを求める規定です。
厚生労働省はCSVの実施にあたり、「医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドライン」を定めています。このガイドラインは、欧米のGAMP5やPIC/S等のCSVガイドラインと整合性があり、コンピュータ化システムの開発から検証、運用、廃棄までのライフサイクルの考え方を採用したものです。「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令(GMP省令)」や、「医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準に関する省令(GQP省令)」に関わる業務を遂行するシステムについては、ガイドラインを遵守する必要があります。
当社のCSV(コンピュータ化システムバリデーション)支援の特徴
当社は、独自にCSV対応の手順を定めた管理規定を保有しています。
このCSV管理規定によって医薬品メーカー様のCSV対応を支援してきた実績に基づき、サービスを展開しています。
システム構築
GMPやCSVに対応した
TONOPS®生産管理システムでスピーディに構築
文書作成
システムベンダーが通常作成する範囲を
超える文書まで作成をサポート
生産ラインのエンジニアリング
グループ会社である東レエンジニアリングと
連携し、ライン構築からシステム導入までを
サポートすることも可能
CSV文書作成支援
(2022年12月末累計)
8件
文書作成サービスについて(オプション)
ガイドラインが要請する項目を踏まえたCSV管理規程を策定し、各種ドキュメントを整備する業務は、多大な労力がかかります。当社の文書作成サービスは、当社独自のCSV管理規程をもとにお客様の業務プロセスや製造ラインを踏まえ、お客様の規程案をとりまとめるなど、規程の検討から支援します。また、規程に基づき開発・検証・運用段階で用意する各種ドキュメントも幅広く対応します。ガイドライン改定への対応や新設備の導入など、お客様の状況に合わせた支援が可能です。
作成が必要なドキュメント
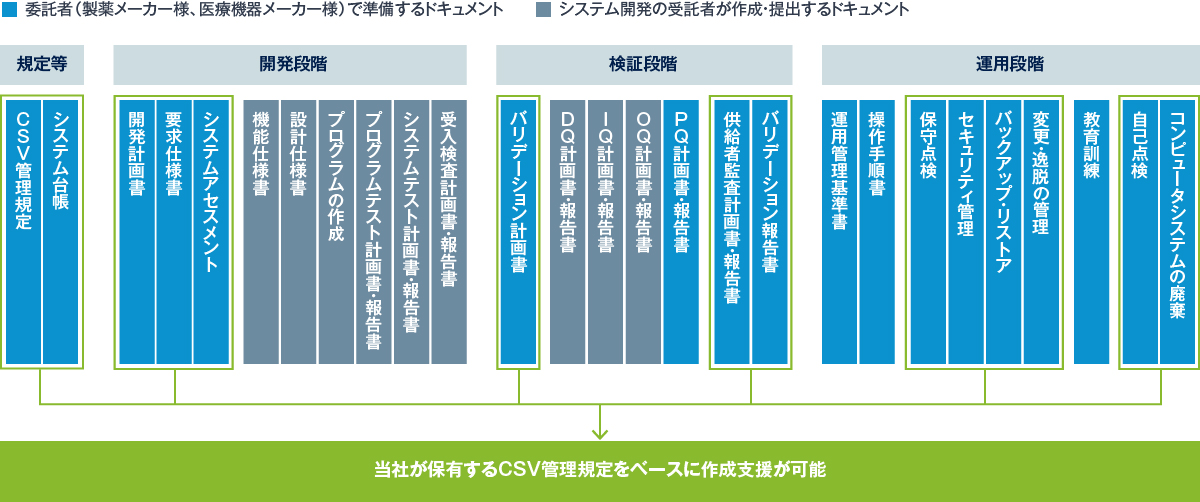
当社のCSV管理規定
当社は医薬品・医療機器の製造ラインのエンジニアリングを行う東レエンジニアリンググループのシステムベンダーとして、東レグループの医薬品部門をはじめ、製薬メーカー様、医療機器メーカー様のシステム構築、CSV対応を支援しています。当社のCSV管理規定は、ガイドラインの改定やISPE(International Society for Pharmaceutical Engineering, Inc.:国際製薬技術協会)の議論を踏まえた項目の検証・拡充を行っています。
CSV管理規定
| 計画 |
|
|---|---|
| 開発 |
|
| 運用 |
|
| 廃棄 |
|
DI管理規定
- データインテグリティ対応指針
- 電子記録管理手順書
- 紙記録管理手順書
- 紙記録レビューシート書式
- 紙記録アーカイブ記録シート書式
- 紙記録廃棄記録シート書式
- DIリスクアセスメント手順書
- コンピュータ化システムDIリスクアセスメントシート書式
- 手続き業務DIリスクアセスメントシート書式
- データ関連外部委託管理手順書
- データサービス受託業者アセスメント質問表
- 監査証跡レビュー手順書
- 監査証跡レビューシート書式
- システム記述書作成手順書
- システム記述書テンプレート
ER/ES管理規定
- ER/ES規制対応規程
- 日本 ER/ES 規制適合の要件と解釈
- 米国 ER/ES 規制適合の要件と解釈
- 欧州 ER/ES 規制適合の要件と解釈
- ER/ES 適合性チェックシート
- ER/ES 対応計画書テンプレート
- ER/ES 対応報告書テンプレート

